Recibido para Arbitraje: 27/04/2015
Aprobado para su publicación: 04/05/2015
La melanina es uno de los pigmentos más comunes y de mayor distribución en la naturaleza. Se puede encontrar en una amplia variedad de seres vivos que incluyen: humanos, animales, plantas, así como en diversos microorganismos tales como bacterias (Vibrio cholerae, Pseudomonas aeruginosa y Mycobacterium tuberculosis, entre otras) y hongos (Histoplasma capsulatum, Criptococcus neoformans y Paracoccidioides brasiliensis, entre otros). Existen evidencias relacionadas con la producción de melanina por parte de cepas de Candida albicans como factor que permite incrementar su capacidad de virulencia. Sin embargo, también existen reportes que señalan la actividad antifúngica de la melanina contra cepas de C. albicans y otras especies de Candida. Es por ello que el objetivo de este artículo es destacar el papel que juega este pigmento tanto a favor como en contra de este hongo.
Palabras clave: Melanina, Candida albicans, agente antifúngico, síntesis, factor de virulencia
Melanin is one of the most common pigments and distributed in nature. It can be found in a wide variety of creatures that include humans, animals, plants, and various microorganisms such as bacteria (Vibrio cholerae, Pseudomonas aeruginosa and Mycobacterium tuberculosis, etc.) and fungi (Histoplasma capsulatum, Cryptococcus neoformans and Paracoccidioides brasiliensis, among others). Evidence related to melanin production by strains of Candida albicans as a factor which can increase its ability to virulence. However, there are reports that indicate the antifungal activity of melanin against strains of C. albicans and other Candida species. That is why the aim of this article is to highlight the role of this pigment both for and against this fungus.
Key words: Melanin, Candida albicans, antifungal agent, synthesis, virulence factor.
Los hongos (latín, fungus=hongos) comprenden un grupo muy diverso de organismos tanto macroscópicos (por ej. hongos en forma de sombrero) como microscópicos, los cuales se encuentran ampliamente distribuidos en la naturaleza, ya que abundan en el suelo, en el agua y en la vegetación, donde suelen vivir por muchos años. Los hongos microscópicos fueron clasificados durante mucho tiempo dentro del Reino Vegetal (hoy día conocido como Plantae) y posteriormente dentro del Reino Protista Superior. Desde hace varios años, estos microorganismos se han reubicado en un solo Reino independiente de los otros, denominado Fungi. Así mismo, los hongos pertenecen al Dominio o Imperio conocido como Eukarya. Los hongos se diferencian de las plantas en la composición de la pared celular y en que carecen de cloroplastos y clorofila1.
En los últimos años, las enfermedades producidas por hongos han ido en aumento, ello debido en gran parte a los avances en la tecnología médica para el diagnóstico de esta infecciones, así como a los trasplantes de órganos y utilización de potentes inmunodepresores, al uso prolongado de esteroides, de antimicrobianos cada vez más potentes y a la aparición de enfermedades muy debilitantes como es el caso del SIDA2,3,4. El aumento de estas infecciones ha sido más notable en las causadas por especies del Género Candida, acompañándose de una elevada morbimortalidad3,5.
Los microorganismos pertenecientes al Género Candida se pueden encontrar frecuentemente en la boca de individuos sanos, razón por la que se consideran parte de la microbiota bucal residente. Se estima en la actualidad que entre 30 y 60% de la población a nivel mundial son portadores de este hongo como comensal oportunista en sus cavidades bucales, así como en las áreas cutánea, gastrointestinal y genitourinaria en el ser humano sano, pero ello va a depender desde luego de la población estudiada. Si bien es cierto que Género Candida comprende más de 200 especies diferentes ampliamente distribuidas en la naturaleza, solamente pocas de estas están implicadas en infecciones en seres humanos, siendo Candida albicans la especie que se encuentra con mayor frecuencia en la cavidad bucal humana tanto en individuos sanos como en casos de Candidiosis bucal. Se ha estimado que del contaje total de levaduras que se encuentran en bocas humanas, más del 80% de estas se identifican como C. albicans. Otras especies de Candida que se han encontrado en cavidad bucal humana son: C. glabrata, C. krusei, C. tropicalis, C. guillermondii, C. dubliniensis, C. kefyr y C. parapsilosis. En años más recientes, se ha reconocido la importancia de las especies de Candida no albicans en enfermedades en humanos. C. glabrata y C. krusei son especies que han recibido especial atención debido a su bien conocida capacidad de resistencia a diversos agentes antifúngicos. De igual forma, se ha destacado la importancia de C. dubliniensis en casos de Candidiasis bucal en individuos infectados en el Virus de Inmunodeficiencia Humana (VIH) 4.
C. albicans, especie denominada así en 1923 por Berkhout y aceptada como tal en 1939 por el 3er Congreso Internacional de Microbiología en Nueva York6, se observa generalmente como una célula oval levaduriforme de 2 a 4 micrómetros, con paredes finas; no obstante, se han encontrado en tejidos infectados formas filamentosas de este hongo, las cuales poseen longitud variable y presentan extremos redondos cuyo tamaño oscila entre 3 a 5 micrómetros de diámetro y seudohifas, que son células alargadas de la levadura que permanecen unidas entre sí 6,7.
Las levaduras o blastosporas son células eucarióticas que se reproducen asexualmente por gemación. Este proceso de división implica la producción de nuevo material celular proveniente de la superficie de la blastospora. Cuando el brote o yema ha crecido y se encuentra en su tamaño óptimo, se produce la división celular, cuestión esta que implica la formación de un tabique o septo entre ambas células7.
La forma filamentosa del hongo es una estructura microscópica tubular, la cual contiene múltiples unidades celulares divididas por septos y puede surgir a partir de blastosporas o de hifas existentes. Esta puede crecer por extensión apical7,8.
La apariencia microscópica de todas las especies de Candida es similar; todas las levaduras son Gram positivas, pero en algunas ocasiones la forma de blastosporas puede cambiar de ovoide a alongada o esférica. Microscópicamente, C. albicans presenta dimorfismo, el cual implica transformación de la forma de levadura a hifa7,8.
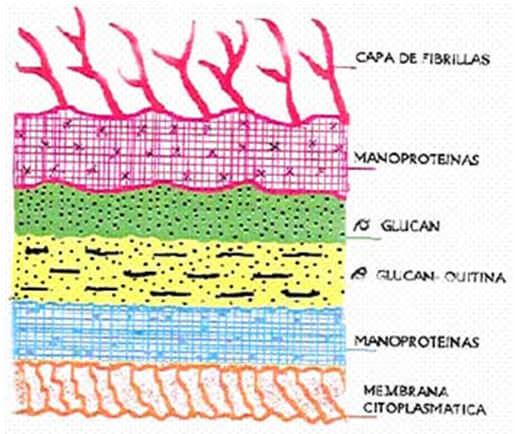
La composición química de C. albicans está representada por 20-40% de proteínas y 30-50% de polisacáridos, mientras que la proporción de lípidos es variable9. La pared celular de este microorganismo está compuesta principalmente por los polisacáridos Manán, Glucán y Quitina10. La mayoría de los investigadores han descrito cinco capas dentro de la pared celular del hongo, las cuales son (de adentro hacia fuera): Manoproteínas, ß-Glucán-Quitina, ß-Glucán, Manoproteínas y una capa de fibrillas11 (FIGURA 1). Sin embargo, Poulain y col.12, observaron hasta ocho o nueve capas en la pared celular de C. albicans, aunque estos resultados se referían a una variedad de paredes celulares provenientes de células que crecieron en diferentes medios de cultivo y en distintos períodos de tiempo.
La membrana citoplasmática es una estructura que reviste gran importancia, ya que los antibióticos antimicóticos actúan a nivel de la misma, además de contener las enzimas responsables de la síntesis de la pared celular. Esta presenta una doble capa de lípidos y posee invaginaciones, que se observan como surcos de 200 a 300 nanómetros de longitud, por 35 a 40 nanómetros de espesor13,14. Además de los lípidos, la membrana citoplasmática está compuesta por grandes cantidades de proteínas y carbohidratos en menor proporción15.
En el citoplasma, al igual que otras células eucarióticas, C. albicans presenta: ribosomas, mitocondrias con doble capa, gránulos de glucógeno y vacuolas que contienen en algunas ocasiones cuerpos lipídicos y gránulos de polifosfato. El núcleo es típico de una célula eucariótica, con membrana nuclear limitante y posee uno o varios nucleolos, ADN y ARN y 7 cromosomas13,16.
El metabolismo de C. albicans se ha relacionado de una forma directa o indirecta con la patogenicidad, la morfología o con los efectos de los antibióticos antimicóticos. El metabolismo de los carbohidratos juega un papel importante en la morfogénesis, en tanto que el metabolismo de aminoácidos y lípidos tiene poca importancia para el crecimiento de este microorganismo17. No obstante, se han detectado tanto en C. albicans, como en otras especies de Candida distintos tipos de fosfolípidos, de los cuales los principales fueron: Fosfatidiletanolamina y Fosfatidilglicerol. Estos compuestos son muy importantes en relación con el normal funcionamiento de la membrana citoplasmática de los hongos18.
La alteración más trivial parece suficiente para permitir que C. albicans produzca una infección localizada y limitada a la mucosa bucal, pero que puede extenderse en casos graves a la faringe y el esófago e incluso producir una infección diseminada. Entre los factores que facilitan la infección candidiásica se destacan: a) la cantidad y el tipo de saliva (p. ej., sequedad bucal o gran humedad en las comisuras labiales); b) la dieta; c) el pH; d) la temperatura; e) la presencia de algunas bacterias o de prótesis dental, ya que el acrílico de las prótesis removibles es un material fácilmente colonizable; f ) el tratamiento con antibióticos y g) los corticosteroides y cualquier tipo de inmunodepresión primaria o adquirida13.
Indudablemente que de las especies de Candida, C. albicans es la especie más virulenta y su capacidad de virulencia se debe a un conjunto de atributos relacionados bien con su habilidad para evadir los mecanismos de defensa del hospedero o de resistir al tratamiento antifúngico o bien con su capacidad de lesionar las células y los tejidos que invade. Los factores de virulencia están controlados por diferentes genes que se expresan en un número determinado y en un momento concreto y que determinan el fenotipo y la virulencia. Por lo tanto, no es sorprendente la variabilidad existente en la virulencia entre las cepas e incluso dentro de una misma cepa con relación a la localización corporal donde produzca la infección. Entre los principales genes conocidos asociados a la virulencia de C. albicans están el de la hexosaminidasa (hex1), varios genes de proteasas aspárticas (Sap1, Sap2, Sap3 y Sap4) y un gen que confiere capacidad de producir tubos germinales y aumentar la adhesión (αInt1)13.
Los factores de virulencia de este patógeno oportunista incluyen su habilidad para sobrevivir como comensal, la adherencia a células del hospedero, la secreción de enzimas degradativas tales como aspartil-proteinasas y fosfolipasas, así como el cambio de morfología19,20. Estos factores de virulencia juegan un papel en cada etapa de la infección por C. albicans. La infección puede dividirse en cuatro etapas:
Las melaninas han sido consideradas como el escudo de los hongos22 por su capacidad de proteger el microorganismo contra un amplio rango de agresiones tóxicas, tanto de tipo ambiental como producto de la respuesta inmune del hospedero durante la infección. Por tal motivo, se ha considerado que las melaninas tienen un papel importante en la virulencia de muchos microorganismos23.
La mayoría de los hongos contienen melanina y la producción de este pigmento puede proteger el organismo de diversas agresiones ambientales24. Particularmente se ha demostrado que cepas de levaduras de C. albicans sintetizan este pigmento como factor de virulencia25. Por otra parte, también se ha demostrado la capacidad de la melanina como agente antifúngico26.
En base a lo anteriormente expresado, el objetivo de este artículo es describir por una parte la actividad de Candida y en particular de C. albicans como microorganismos productores de melanina, así como las condiciones que favorecen o no su producción y por la otra, la actividad antifúngica de este pigmento sobre los hongos antes mencionados.
Los melanocitos son células dendríticas derivadas de la cresta neural que se localizan en el estrato basal de la epidermis interactuando con los queratinocitos en una razón de 1:30. Su principal función es la síntesis de un pigmento denominado melanina26,27.
La melanogénesis es un proceso que ocurre en organelos especializados llamados melanosomas, que se forman en el aparato de Golgi. Una vez sintetizada la melanina, ésta es transferida a los queratinocitos mediante exocitosis 27,28.
La melanina no es una sustancia única: se la considera como un amplio grupo de sustancias (pigmentos) que tienen propiedades similares29,30. La melanina es un pigmento ubicuo distribuido en todos los reinos biológicos. En general, se ha descrito como un pigmento oscuro, negro o café; sin embargo, puede presentar otros colores. Son moléculas con alto peso molecular, muy estables, amorfas, cargadas negativamente, resistentes a la degradación con ácidos pero susceptibles a la degradación con bases fuertes, hidrofóbicas, insolubles en agua o solventes orgánicos, las cuales son formadas por la polimerización oxidativa de compuesto fenólicos o indólicos. Las melaninas derivadas de levodopa (3,4-dihidroxi-L-fenilalanina) (L-DOPA) son llamadas eumelaninas y característicamente son negras o café; las melaninas amarillas o rojizas son llamadas feomelaninas e incorporan cisteína con L-DOPA; las piomelaninas son otras melaninas de color café, están formadas por compuestos del ácido homogentísico a partir de tirosinasas; y las melaninas de dihidroxinaftaleno (alomelanina) son pigmentos derivados a partir de acetatos por la vía de la polikétido sintasa y, generalmente, son de color negro o café 22,31,32.
Hasta el momento han sido muchas las características que se le ha conferido a la melanina. Se sabe que protege las bacterias como Vibrio cholerae del choque térmico e hiperosmolar en los estuarios, generando así bacterias resistentes estos cambios ambientales33. En otras especies, la producción de este pigmento es usado en la taxonomía del género, como es el caso de Streptomyces34. Entre los parásitos más estudiados para melanina y las enzimas que la sintetizan, encontramos Fasciola gigantita35, Isoparorchis hypselobagri36, Trichuris suis37 y Trichuris muris38.
En relación con los hongos, se han estudiado tanto en aquellos patógenos de importancia para el humano, como en otros de tipo ambiental y de interés biotecnológico, en los cuales se ha encontrado que las melaninas son importantes para la supervivencia y la longevidad de las propágulas micóticas 39.
La melanina también funciona como sistema de evasión de los mecanismos inmunológicos del hospedero. Se sabe que la melanina de la uva tiene propiedades inmunomoduladoras, principalmente en la disminución de las citocinas de tipo proinflamatorias40. Otras observaciones sugieren que la melanina contribuye a la virulencia de los agentes micóticos, protegiéndolos de la respuesta de defensa del hospedero, pueden activar la cascada del complemento41, protegerlos frente a agentes oxidantes42,43, reducir la fagocitosis o la inducción de la muerte celular43,44, inducir una fuerte respuesta de anticuerpos45 y generar disminución en la absorción de ciertos medicamentos en los tejidos del hospedero, representada por la resistencia o la disminución de la sensibilidad a los compuestos antimicrobianos, como son la anfotericina B y la caspofungina46,47. No obstante, en la actualidad no se conoce completamente el rol de la melanina en la piel y otros tejidos animales48. La principal función de la melanina en la piel humana parece ser la protección frente a los radicales libres formados por la radiación ultravioleta (UV)49. Sin embargo, existen estudios que rechazan esta hipótesis exponiendo que la melanina no resultaría efectiva por sí sola para evitar la formación de dímeros de pirimidina por radiación UV50.
Diversos estudios han demostrado que la función de los melanocitos no sólo comprende la protección del daño por radiación UV, sino que además, actúan como células inmunes que reconocen estructuras conservadas presentes en los microorganismos, llamadas PAMPs (pathogen-associated molecular patterns o patrones moleculares asociados a patogenicidad); es así como en algunos estudios se ha descrito que la melanina, sintetizada en los melanocitos, presenta actividad antimicrobiana y que los melanocitos al ser expuestos a PAMPs incrementan la síntesis de melanina, por lo que el proceso de melanización podría ser importante como mecanismo protector de la respuesta inmune innata51.
El mecanismo de acción de la melanina no se conoce aún; sin embargo, se ha descrito actividad inhibitoria y fungicida de intermediarios de quinonas reactivas producidas durante la biosíntesis de melanina per se y/o por la producción de peróxido de hidrógeno debido a la estructura aromática de estos componentes27. También hay evidencia que sugiere que la melanina es capaz de absorber varios compuestos orgánicos e inorgánicos actuando como un “cationito”; mediante esta propiedad, la melanina es capaz de unir toxinas bacterianas como la toxina botulínica38 y podría absorber diferentes compuestos de la pared celular de C. albicans o directamente romper la membrana plasmática. Se requieren más estudios para comprender cabalmente el mecanismo de acción de este pigmento 26.
El uso de anticuerpos monoclonales es un mecanismo por el cual puede reconocerse, de modo indirecto y preliminar, la existencia de melanina en una determinada muestra, debido a que este compuesto posee una estructura y posibles factores determinantes antigénicos bastante conservados. En general, todos estos anticuerpos monoclonales, tanto los isotipos IgM como los IgG, reportados por nuestro grupo, tienen la capacidad de reconocer múltiples fuentes de melanina, a saber: melaninas comerciales (Sigma) sintética, Sepia officinalis, melaninas de conidias de Aspergillus fumigatus, Sporothrix schenckii, Penicillium marneffei, Aspergillus niger y Paracoccidioides brasiliensis, y melaninas de levaduras de Criptococcus neoformans, C. albicans y P. brasiliensis52.
C. albicans produce partículas de melanina in vitro y durante la infección25,53,54. Se han aislado partículas de melanina a partir de células levaduriformes de C. albicans y de tejido infectado proveniente de riñón de murino y de piel humana. La producción de este pigmento oscuro ocurrió después de 3 a 4 días de incubación en un medio que contiene L-3,4- dihidroxifenilalanina (L-DOPA) como sustrato25. También se conoce el rol protector de la melanina frente a enzimas hidrolíticas, antifúngicos, péptidos antimicrobianos, radiación ultravioleta y temperatura53,54.
Las partículas de melanina aisladas poseen un cuarto del tamaño de las células de levadura que las produce, lo que se pudo evidenciar por microscopía electrónica de barrido, en tanto que la microscopía electrónica de transmisión reveló que las partículas de melanina de C. albicans poseen pequeñas capas delgadas de material electrodenso que rodea un vacío25.
En un estudio realizado por Walker y col.55, estos investigadores revelaron que la melanina se exterioriza de las células fúngicas en la forma de melanocitos electrodensos que estaban libres o, a menudo débilmente unidos a la parte externa de la pared celular. La producción de melanina fue impulsada por la adición de N-acetilglucosamina al medio, lo que indica una posible asociación entre la producción de melanina y la síntesis de quitina. Este estudio proporciona pruebas claras de que los melanosomas se forman intracelularmente en C. albicans y viajan a través de la pared celular al exterior.
En C. albicans, la quitina se sintetiza por la acción de enzimas codificadas por cuatro genes: CHS1, CHS2, CHS3 y CHS8 y está coordinadamente regulada por al menos tres vías de señalización56. Mientras CHS1 es un gen esencial en condiciones normales, los otros tres genes no son esenciales para la viabilidad de la especie57. Se ha asociado la producción de melanina con la presencia o ausencia de uno o varios de estos genes que codifican la síntesis de quitina de la pared celular de este hongo. Así, por ejemplo; los melanosomas quedan retenidos en el citoplasma de C. albicans cuando está ausente el gen funcional CHS2 y no pueden ser externalizados. Por otra parte, la ausencia del gen CHS3 influye en el progreso de la producción de melanina en un sitio dentro de la estructura de la pared celular aunque sin completar su externalización. La externalización normal de la melanina fuera de la pared celular del microorganismo ocurre en ausencia del gen CHS855.
Se ha demostrado además que levaduras de C. albicans secretan polímeros complejos en las estructuras de biopelícula58, cuya composición no se entiende completamente; por lo tanto, una hipótesis podría ser que las partículas de melanina se secretan dentro de estas estructuras extracelulares resistentes25.
Ya sea o no que la producción de melanina es un atributo necesario de C. albicans en su papel como comensal o patógeno, está demostrado que la adición de dihidroxifenilalanina (DOPA) a un medio de cultivo que permita el crecimiento del hongo estimula la formación de melanina. Muchas cepas de C. albicans forman la melanina bajo estimulación con DOPA, aunque algunas lo hacen más fácilmente que otras. La melanina se produce después del cese de la fase de crecimiento activo (fase exponencial de la curva de crecimiento microbiano) y por ende se considera un probable metabolito secundario (sintetizado en la fase estacionaria de la curva de crecimiento)25,55.
Aunque la melanina es producida por hongos patógenos y se considera un factor de virulencia43,54, también presenta actividad antimicrobiana27,48. También, existen evidencias que sugieren que en población de piel oscura existiría una mayor resistencia a infecciones por Trychophyton mentagrophytes y C. albicans 59. Es conveniente destacar además que se ha demostrado una relación genética y bioquímica entre los procesos de inmunidad y melanización. Dichos estudios han reportado que, tanto los melanocitos como la melanina, inhibirían la proliferación bacteriana y fúngica en la dermis y epidermis60.
En un ensayo de sensibilidad realizado por Fuentes y col.26, empleando cepas de Candida spp. ATCC (C. albicans SC5314, C. parapsilosis 22019, C. glabrata 2001 y C. krusei 6258) y 56 cepas provenientes de aislados clínicos (C. albicans (n: 33), C. glabrata (n: 12), C. famata (n: 3), C. krusei (n: 3), C. parapsilosis (n: 3) y C. tropicalis (n: 2)), se observó un efecto inhibitorio de la melanina sintética en la totalidad de las cepas analizadas, Se incluyeron en el estudio cepas sensibles, sensibles dosis dependiente (SDD) y resistentes a fluconazol y se observó que la melanina tuvo actividad antifúngica en cepas sensibles, sensibles dosis-dependiente y resistentes a fluconazol, tanto en las cepas de C. albicans como en cepas no-albicans a concentraciones iguales o inferiores a 50 μg/mL. Así mismo, este estudio reveló que al analizar la distribución de las concentraciones inhibitorias mínimas (CIMs), tanto en cepas clínicas como en cepas ATCC, de acuerdo a la especie se encontró que C. glabrata presentó CIMs más bajas en promedio que C. albicans, mientras que C. krusei presentó CIMs más altas a melanina.
Cabe destacar que C. glabrata, especie que tiende a presentar mayor resistencia a los antifúngicos convencionales, fue la especie más sensible a melanina, lo que sugiere un mecanismo defensivo importante de piel y mucosa, además de una probable alternativa de tratamiento interesante de estudiar26.
También se ha observado que melanocitos estimulados con hifas inhiben mucho más el crecimiento de C. albicans que melanocitos estimulados con blastoconidias. Esto es interesante pues probablemente el estado patogénico de C. albicans (hifa), induce una mayor melanización, lo cual sugiere que melanocitos podrían discriminar entre blastoconidia e hifa, al igual que otras células inmunes no profesionales como células epiteliales26,61. Adicionalmente, se observó que células con un alto contenido de melanina, como las células de melanoma de ratón B16, inducen una mayor inhibición del crecimiento de C. albicans, principalmente si éstas fueron estimuladas con extractos de la levadura.
En un estudio de data reciente, publicado por Allam y Abd El-Zaher 62, estos investigadores han demostrado que la melanina sintetizada por el hongo en forma de sombrero denominado Bjerkandera adusta es inmunogénica contra la infección por hongos microscópicos entre estos C. albicans, razón por la que han sugerido que podría emplearse para la elaboración de una vacuna que prevenga contra la candidiasis sistémica.
Los melanocitos son células presentes en piel y en mucosas que sintetizan melanina. Existen evidencias más que suficientes que demuestran el hecho de que cepas de C. albicans sintetizan partículas de melanina las cuales al exteriorizarlas actúan como factor de virulencia. Por otra parte, se sabe que la melanina presenta actividad antimicrobiana y que los melanocitos se melanizan al ser expuestos a moléculas microbianas. La melanina es capaz de inhibir cepas clínicas de Candida spp. y la melanización podría ser un importante mecanismo protector de los melanocitos.
Tomando en cuenta lo anteriormente dicho, la melanización puede ser un blanco atractivo para nuevos medicamentos antimicrobianos; por lo tanto, la investigación en relación con el desarrollo de nuevos compuestos inhibidores de la melanina debe ser un objetivo a perseguirse en el futuro.