Recibido para Arbitraje: 25/08/2015
Aceptado para Publicación: 10/10/2015
A lo largo de los años se han realizado múltiples investigaciones relacionadas con el desarrollo de materiales y técnicas que permitan la rápida recuperación de los tejidos en cavidad bucal; esto ha llevado a los investigadores a la búsqueda y evaluación de biomateriales que permitan acelerar el proceso de cicatrización; dichos estudios proponen el uso de concentrados plaquetarios ricos en factores de crecimiento para disminuir el tiempo restaurativo de una lesión. Uno de estos es la Fibrina Rica en Plaquetas (FRP), la cual cuenta con numerosas propiedades, pero son pocos los estudios que relacionan su capacidad en los procesos de cicatrización de los tejidos blandos; por tanto el objetivo de esta investigación fue determinar el efecto de la Fibrina Rica en Plaquetas sobre los procesos de cicatrización de los tejidos blandos posterior a la exodoncia de terceros molares inferiores retenidos. Bajo una investigación de tipo confirmatoria y diseño experimental, se seleccionaron 5 pacientes a quienes se les realizó la extracción de ambos terceros molares, posteriormente se aplicó la FRP en uno de los lados (lado estudio) y en el lado contrario no se aplicó ningún biomaterial (lado control), se evaluó la cicatrización de las heridas a las 24 horas, a los 7, 15, 45 días. Clínicamente se observó que la FRP fue favorable en las variables dolor, color y consistencia pero no fue posible determinar en qué medida moduló la respuesta inflamatoria. Se concluye entonces que la FRP podría actuar como acelerador en el proceso de cicatrización de los tejidos.
Palabras clave: Fibrina Rica en Plaquetas, Cicatrización, Tercer Molar Inferior.
Over the years performed multiple investigations related to the development of materials and techniques that enable rapid recovery of the tissues in the oral cavity; This has led researchers to search and evaluation of biomaterials allowing to speed up the healing process; These studies propose the use of concentrated platelet rich in growth factors to restorative time of injury. One of these is the fibrin rich in platelets (FRP), which has many properties, but there are few studies that relate its capacity in soft tissues healing processes; Therefore the aim of this research was to determine the effect of the platelet-rich fibrin on the processes of healing of soft tissues after removal of lower retained third molars. The research was confirmatory type and experimental design, we selected 5 patients who underwent both third molar extraction, then applied the FRP on one side (studio side) and on the opposite side did not apply any biomaterial (control side), healing of the wounds was evaluated at 24 hours, 7, 15 and 45 days. Clinically it was observed that the FRP was favorable in the variables pain, color and consistency but it was not possible to determine to what extent the inflammatory response module. It is concluded that the FRP could act as an accelerator in the soft tissues healing process.
Key words: Fibrin rich in platelets, healing, lower third Molar.
CORRESPONDENCIA: [email protected]
En la actualidad la extracción de los terceros molares es uno de los procedimientos quirúrgicos más comunes; en especial en los casos de los terceros molares inferiores retenidos los cuales adoptan distintas posiciones dentro de la arcada dentaria, lo que condiciona la complejidad de muchas de éstas cirugías y sus implicaciones postquirúrgicas. Además, es durante este procedimiento, cuando el cirujano u odontólogo general se ve en la necesidad de realizar incisiones que permitan el acceso quirúrgico, en donde el proceso de cicatrización de dichas heridas juega un papel importante en el post-operatorio del paciente.
La regeneración de los tejidos duros y blandos tiene lugar a partir de una serie de eventos que a nivel celular y molecular son regulados por las proteínas. La activación plaquetaria en respuesta al daño tisular y vascular provoca la formación de un tapón plaquetario, luego un coágulo hemático cuyas funciones son la consecución de la hemostasia y la secreción de proteínas biológicamente activas involucradas en el proceso de curación tisular en el que las plaquetas juegan un papel importante1.
El proceso de cicatrización de los tejidos bucales forma parte de un fenómeno que suele ocasionar incomodidad en los pacientes2. Por ello, en la búsqueda de terapias que minimicen la convalecencia post-quirúrgica, un gran número de investigadores se han abocado hacia el empleo de materiales bioactivos de origen autólogo como lo son los concentrados plaquetarios ricos en factores de crecimiento, pues disminuyen el tiempo restaurativo de una lesión, estimulando la proliferación y la diferenciación celular en aquellos tejidos donde sea requerido, tal como sucede en las heridas y los procesos de regeneración.1
Buscando reducir las complicaciones que se pueden presentar durante el procedimiento quirúrgico aparece una nueva generación de concentrados plaquetarios conocida como Fibrina Rica en Plaquetas (FRP) 3-7. La cual fue desarrollada por primera vez en Francia por Choukroun5 en el año 2001, para uso específico en el campo de la Cirugía oral y Maxilofacial. Ha sido empleada ampliamente en la regeneración ósea y tisular guiada, para contribuir en los mecanismos de reparación en alvéolos8,9, elevación y cierres de comunicaciones10,11, cierre de fístulas12, defectos periodontales13, tratamientos de pulpotomía14, entre otros.
Por otra parte, el procedimiento quirúrgico más común en cavidad bucal es la exodoncia de terceros molares, la cual trae consigo la aparición de complicaciones post-operatorias como: la inflamación, dolor y en el 15.6% de los casos hemorragia persistente y el retraso de la cicatrización 7. Es por tanto que surge la necesidad de utilizar un biomaterial que contribuya a disminuir la incidencia de estas complicaciones y cuyas propiedades brinden un post-operatorio óptimo para el paciente.
Al respecto, en varias investigaciones 8-15 se ha estudiado el empleo de Fibrina Rica en Plaquetas (FRP) en regeneración ósea y tisular guiada, pero después de realizar una revisión exhaustiva de antecedentes se evidenció que aun cuando ésta cuenta con numerosas propiedades, son escazas las publicaciones que evalúan la capacidad y utilidad de este biomaterial en los procesos de cicatrización de los tejidos blandos de la cavidad bucal posterior a la exodoncia de terceros molares. Es a partir de ello que nace la propuesta de valorar la FRP como biomaterial para optimizar la cicatrización de los tejidos blandos en cavidad bucal.
Se realizó un estudio de tipo confirmatorio, experimental y longitudinal. La población de estudio estuvo conformada por pacientes que acudieron a la Cátedra de Cirugía y Anestesiología Estomatológica de la Facultad de Odontología de la Universidad de Los Andes, con requerimiento de exodoncia de ambos terceros molares inferiores. Se seleccionaron 5 pacientes en base a un muestreo no probabilístico, que cumplieron con criterios de inclusión como, estar en edades comprendidas entre 18 años a 26 años de ambos sexos, tener ambos terceros molares inferiores. Así como también, fueron excluidos pacientes con enfermedades sistémicas degenerativas que afecten la reparación tisular (diabetes mellitus, hipertensión arterial), con infecciones en cavidad bucal, mujeres embarazadas y pacientes que estuviesen bajo medicación inmunosupresora y/o anticoagulante.
Una vez seleccionados los pacientes se les hizo entrega y de un consentimiento informado, de acuerdo a lo establecido en los principios éticos de Helsinski. Seguido a la aceptación por parte del paciente, se tomó una muestra sanguínea de 5ml, que fueron centrifugados por 10 minutos a 2030 r.p.m. en un tubo de ensayo estéril sin anticoagulante, obteniendo así el biomaterial a utilizar; según el procedimiento propuesto por Choukroun5 modificado en el laboratorio de Investigaciones Odontológicas de la Facultad de Odontología de la Universidad de Los Andes.
Antes de comenzar con el acto quirúrgico, se realizó la asepsia del campo operatorio y se diseñó la incisión envolvente, para levantar el correspondiente colgajo mucoperióstico y poder ejecutar los siguientes pasos quirúrgicos (osteotomía, extracción propiamente dicha de la pieza dentaria y limpieza del alveolo). Posterior a la extracción de los terceros molares inferiores, se esperó por la formación del coágulo sanguíneo inmediato en los alveolos y se colocó el coágulo de FRP inmediatamente por debajo del colgajo mucoperióstico en uno de los lados que fue seleccionado de forma aleatoria (lado estudio), del lado contrario no se colocó biomaterial (lado control). Finalmente, se suturó con seda negra (3 -0), a punto separado y se dieron las indicaciones postoperatoria.
Se realizaron controles periódicos al día, 7, 15 y 45 días, donde se registró el dolor experimentado por el paciente a través de la escala visual análoga (EVA). La cual es una medida unidimensional del dolor que permite apreciar subjetivamente la intensidad de dolor que refiere el paciente, consta de una puntuación entre 0 a 10, donde el 0 indica ausencia del dolor y el 10 el dolor más fuerte. Los indicadores de medición para esta escala fueron: Dolor leve: se considera entre las puntuaciones 1 a 3. Dolor moderado: cuando el paciente refiere puntuaciones entre 4 y 7. Dolor severo: el que se encuentra entre 8 y 10 puntos16. Los resultados se obtuvieron a partir de las escalas aplicadas para la valoración de color, consistencia, sangrado y edema. Se utilizó la estadística descriptiva para cada una de las valoraciones clínicas pautadas (24 horas y a los 7, 15 y 45 días). De igual manera, la evaluación de dichos aspectos se comparó entre los lados estudio y control.
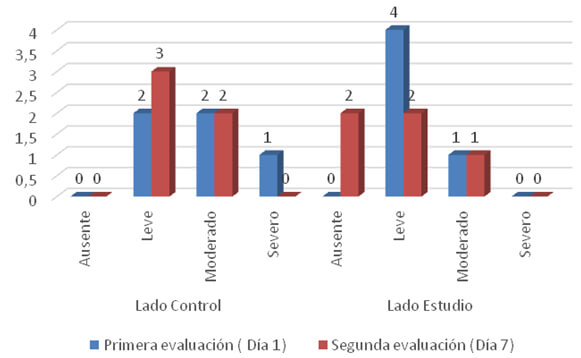
En torno a los niveles del dolor experimentados por los pacientes en los días 1 y 7 posteriores al evento quirúrgico, se registró que al día 1, 40% (2) de los pacientes padecieron de dolor leve en el lado control, 40% (2) con dolor moderado y con dolor severo el 20% (1). Mientras que en el lado estudio tratado con FRP se encontró que la mayoría, es decir el 80% solo manifestaron un dolor leve. Por otra parte, al día 7 en el grupo control, el dolor leve prevaleció (60%). La sintomatología fue diferente en el lado estudio, que se caracterizó por ausencia de dolor (40 %), dolor leve (40%) y dolor moderado (20%) (Ver gráfico 1). En las dos evaluaciones restantes a los 15 y 45 días tanto del lado control como del lado estudio los pacientes no manifestaron dolor en el área evaluada.
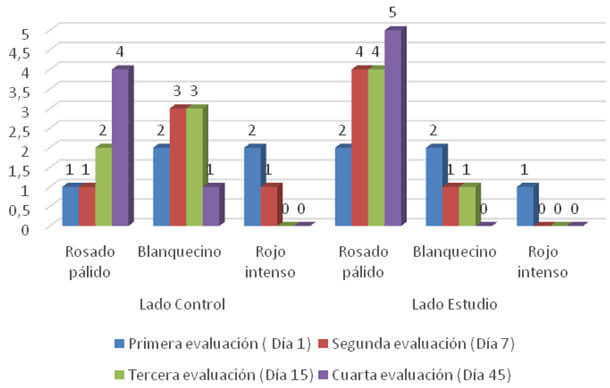
En el gráfico N°2 se presentan los resultados obtenidos en cuanto a la evaluación del color de la mucosa. En el día 1 se observó en el lado control un paciente con coloración rosado pálido (20%), 2 pacientes presentaron coloración blanquecina (40%) y 2 pacientes coloración rojo intenso (40%). Mientras que para el lado estudio se observaron 2 pacientes con coloración rosado pálido (40%), 2 pacientes presentaron coloración blanquecina (40%) y 2 pacientes coloración rojo intenso (20%).
En cuanto al lado control al día 7, se observó un paciente con la mucosa de color rosado pálido (20%) 3 pacientes presentaron coloración blanquecina (60%) y un paciente rojo intenso (20%), mientras que las del lado estudio 4 pacientes presentaron mucosa de color rosado pálido (80%) y un paciente coloración blanquecina (20%).
Para la tercera evaluación (15 días) en el lado control se presentaron 2 pacientes con la mucosa color rosado pálido (40%) y 3 pacientes con coloración blanquecina (60%) y para el lado de estudio en 4 pacientes se observó la mucosa color rosado palido (80%) y un paciente con coloración blanquecina (20%). Al momento de la última evaluación (45 días), en el lado control se observaron 4 pacientes con la mucosa color rosado pálido (80%) y un paciente aun presentaba coloración blanquecina (20%). A diferencia del lado de estudio donde todos los pacientes (5) presentaban la mucosa con coloración rosado pálido (100%).
En cuanto a la evaluación de la consistencia se aprecia en el gráfico N°3, que tanto los pacientes del grupo control como los del grupo de estudio al día 1 se encontraban en similitud de condiciones, pues todos presentaron una consistencia blanda (5:5); al realizar segunda evaluación (día 7) para el lado control los 5 pacientes mantuvieron consistencia blanda (100%) y en cuanto al lado de estudio 4 pacientes presentaron una consistencia blanda (80%) y solo uno de ellos consistencia firme (20%). Es importante resaltar que a los 15 días posteriores a la cirugía en el lado control 2 pacientes presentaban consistencia firme (40%) y tres consistencia blanda (60%) y en cuanto al lado estudio la totalidad de los pacientes presentaban la mucosa con consistencia firme (100%).
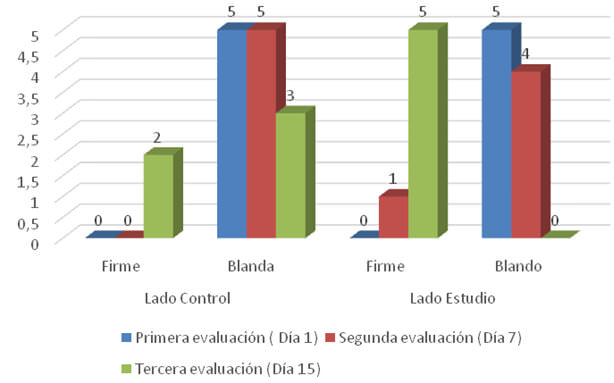
Al momento del último control realizado a los 45 días, todos los pacientes tanto del lado control como del lado estudio presentaban consistencia firme (100%).
En la primera evaluación el sangrado fue reportado por los pacientes en igualdad de proporciones para ambos grupos: en 3 pacientes el sangrado estuvo ausente (60%) y en 2 hubo presencia a la palpación (40%). Al día 7 se observó que tanto para el lado control como para el lado estudio en 4 pacientes el sangrado estuvo ausente (80%) y en un paciente el sangrado ocurrió solo a la palpación (20%). En las dos evaluaciones restantes a los 15 y 45 días tanto del lado control como del lado estudio los pacientes no presentaron sangrado.
En cuanto a la presencia de edema, en la primera evaluación en el lado control solo 3 (60%) pacientes cursaron con edema, siendo de tipo leve. En contraparte, en el lado estudio se presentaron 2 pacientes con edema leve (40%) y 3 (60%) pacientes con edema moderado. Los niveles de inflamación fueron disminuyendo a los 7 días en ambos grupos, observándose la presencia de edema leve en todos pacientes de ambos grupos (100%). En las evaluaciones realizadas a los 15 y 45 días tanto del lado control como del lado estudio los pacientes no presentaron edema.
Los factores de crecimiento se conocen como intermediarios biológicos que se encargan de la proliferación, diferenciación y quimiotaxia celular, así como también de la formación de matriz extracelular, estos factores juegan un papel importante en la regeneración de tejidos duros y blandos. En el proceso de cicatrización, los factores de crecimiento son liberados cuando las plaquetas se degranulan, por lo tanto si existe un mayor número de plaquetas en el sitio de la lesión, se liberará mayor número de estos factores y la cicatrización será más rápida, éste es una de las ventajas de usar concentrados plaquetarios en la regeneración ósea17.
En la presente investigación se pudo apreciar el mencionado efecto benéfico del empleo de concentrados plaquetarios en heridas postexodoncia. Específicamente en cuanto al parámetro del dolor se apreció que el mismo fue manifestado con menor intensidad en el lado estudio; se puede decir que la FRP contribuyó en la disminución del dolor de los pacientes atribuyendo dicho resultado a la liberación de factores de crecimiento y mediadores los cuales juegan un papel importante en los procesos inflamatorios.
Esto coincide con lo planteado Tofller y cols3 en el 2009 quienes indicaron que la presencia de leucocitos y citoquinas en la red de fibrina pueden jugar un papel significante en la autorregulación de la inflamación y así mismo ayudar a la disminución del dolor. Así mismo Hiremath y cols7 en 2012 manifestaron el efecto de la FRP en la disminución del dolor, atribuido a la concentración de plaquetas que lo conforman, las cuales liberan factores de crecimiento y mediadores químicos que estabilizan la herida; fortaleciendo los mecanismo de defensa y protección de la lesión, disminuyendo el periodo inflamatorio causante del dolor.
En lo referente a la coloración de la herida, se destaca que desde la primera evaluación (1er día) se observó un efecto favorable de la FRP se encontraron más pacientes con la coloración rosa pálido (asociada a la etapa de remodelación) en contraparte con el grupo control quienes presentaron coloración rojo intenso.
Al momento de la segunda evaluación (7mo día) las zonas de estudio se encontraban con coloración blanquecina y rosa pálido es decir se encontraban en las últimas etapas de la cicatrización; a diferencia del lado control que aún mantenía un paciente con coloración rojo intenso.
Para la tercera evaluación la mayoría de las zonas de estudio se encontraban de color rosa pálido, en comparación con las del lado control que aún se encontraban con coloración blanquecina. En el último control realizado se observó que todos los pacientes pertenecientes al lado estudio se encontraban en la fase de remodelación es decir su coloración final fue rosa pálido, a diferencia del lado control aún un paciente se mantenía con una coloración blanquecina.
De acuerdo con el comportamiento observado, pareciera que el biomaterial tuvo un efecto benéfico ya que se logró que la herida pasara a los últimos estadios de la cicatrización en menor tiempo en comparación a las zonas pertenecientes al grupo control; atribuyendo dicho resultado a la presencia de los factores de crecimiento y a la rápida remodelación de las fibras colágenas por la presencia del biomaterial18,19.
En cuanto al parámetro de consistencia se observó una mejoría al día 7 en el lado de estudio ya que se presentó consistencia firme en uno de los casos; para el día 15 todos los pacientes presentaban dicha consistencia en contraste con el lado control que aún presentaba casos con consistencia blanda. Finalmente, para el día 45 todos los pacientes alcanzaron una consistencia firme, dicho resultado se debió posiblemente a la función oclusiva que presenta la FRP evitando la invaginación del tejido. Sin embargo no se encontraron estudios previos que respalden el comportamiento del biomaterial ante este parámetro.
Por otra parte, aunque la inflamación es el primer evento que ocurre luego de la lesión y dura entre 3 y 7 días en ausencia de factores que la prolonguen, la influencia positiva del empleo de concentrados plaquetarios rico en factores de crecimiento para modular la respuesta fisiológica de la cicatrización suele ser notable y conveniente, como lo evidencian otros autores que han aplicado PRP en heridas postextracción de terceros molares. Garay y cols. en 201420 en torno al edema como indicador a evaluar en el proceso de cicatrización de los tejidos blandos postexodoncia, indican que con el uso del PRP es posible abreviar el periodo de este primer estadio de la cicatrización.
En el presente estudio, se observó que al día siguiente de la cirugía se presentó menor edema en las zonas control. En contraste con la evaluación realizada a los siete días donde se observó disminución del edema en todos los pacientes. Sin embargo, esta aparente mejoría pudo obedecer a que el tiempo de osteotomía en este grupo fue menor, influyendo positivamente en la intensidad del edema.
Esta respuesta difiere de lo registrado por la mayoría de los autores, quienes refieren que el FRP ejerce un efecto en la modulación de la respuesta inflamatoria, una investigación que respalda esta explicación es la de Kiran y cols. en 20112, quienes llevaron a cabo un meta análisis con el fin de evaluar la aplicación clínica de la Fibrina Rica en Plaquetas. Los autores resaltan que las moléculas presentes en el coágulo de Fibrina como en el caso de las citoquinas, son capaces de intervenir en la regulación de las reacciones inflamatorias; llegando a la conclusión de que a este biomaterial se le atribuyen beneficios como la disminución del edema que ocurre tras la liberación de citoquinas presentes en las plaquetas, que modulan los procesos de activación, proliferación y diferenciación de los leucocitos, jugando un papel importante en los mecanismos de la inflamación.
La FRP se perfila como un biomaterial capaz de acelerar los procesos de cicatrización de los tejidos blandos de la cavidad bucal. En el desarrollo de los controles clínicos post- quirúrgicos, se logró evidenciar que los tejidos blandos en contacto con la FRP presentaron mejorías en cuanto al dolor, color, consistencia; con respecto a las heridas control. Desde el punto de vista clinico no se observaron diferencias en cuanto a la disminución del edema postoperatorio en los pacientes intervenidos, por lo tanto la aplicación de la FRP para este parámetro no fue concluyente.