Correnti M. Jefe del Laboratorio de Genética, Instituto de Oncología y Hematología, Ministerio de Salud, Caracas, Venezuela. Profesor Agregado, Jefe del Centro de Biotecnología aplicado a la Odontología, Instituto de Investigaciones Odontológicas Raul Vincentelli, Facultad de Odontología, Universidad Central de Venezuela, Caracas, Venezuela
Gutierrez R. Maestría de Medicina Estomatológica, Facultad de Odontología, Universidad Central de Venezuela, Caracas, Venezuela.
Perrone M. Profesor Titular, Jefe del Laboratorio de Microbiología, Instituto de Investigaciones Odontológicas Raul Vincentelli, Facultad de Odontología, Universidad Central de Venezuela, Caracas, Venezuela.
RESUMEN |
INTRODUCCION
La Estomatitis Aftosa Recurrente es una de las afecciones ulcerativas más frecuentes de los tejidos blandos de las mucosas, caracterizadas por ser dolorosas, superficiales, solitarias o múltiples limitadas a la mucosa no queratinizada. (1,2). Las investigaciones epidemiológicas de la EAR revelan un amplio rango de ocurrencia (5-60%), dependiendo de las características del grupo de estudio y el modo de evaluación. (3)
A pesar de la prevalencia de la EAR, su etiología no está clara y resulta un enigma para los investigadores, ya que lesiones clínicas asociadas con gran número de procesos locales y sistémicos muy diferentes, muestran los mismos rasgos histopatológicos. (4)
La Estomatitis Aftosa Recurrente (EAR) está definida como la presencia de úlceras recurrentes confinadas a la mucosa bucal, en pacientes sin otros signos o síntomas de enfermedad subyacente. Aproximadamente 1 de 5 personas en el mundo están afectadas, con una edad común de inicio entre los 10-19 años. En los países angloparlantes estas lesiones se conocen comúnmente como "canker sores". (5)
A pesar de la prevalencia de la EAR, la etiología de la enfermedad no está clara y resulta un enigma para los investigadores, ya que lesiones clínicas asociadas con gran número de procesos locales y sistémicos muy dispares muestran los mismos rasgos histopatológicos. (6)
El término griego aphthae fue inicialmente usado en relación a las enfermedades de la boca y esta acreditado a Hipócrates (460-370 A C). La Estomatitis Aftosa Recurrente fue descrita por primera vez en 1888, y ahora es una de las enfermedades de la cavidad bucal más prevalentes y conocida en seres humanos. Está caracterizada por ser una ulceración espontánea, auto-limitada a la mucosa bucal, dolorosa, poco profunda, que recurre a intervalos variables en pacientes sin otros signos de enfermedad, dando como resultado una notable discapacidad. Las lesiones pueden presentarse únicas o en grupos y usualmente afectan la mucosa no queratinizada. (6)
ETIOLOGÍA
La EAR es una enfermedad muy común cuya etiología no se conoce con exactitud, diversos factores etiológicos han sido involucrados en esta enfermedad y una gran cantidad de evidencias sugiere una base predominantemente inmunológica. También una fuerte predisposición genética ha sido demostrada. Además, un número de factores predisponentes locales y generales han sido detectados y pueden jugar un papel importante en su aparición. (7)
La mayoría de los pacientes con EAR están por lo demás sanos, y aunque es una entidad aislada, la presencia de lesiones crónicas de EAR se asocia con procesos sistémicos, de los cuales los más comúnmente asociados son el síndrome de Behçet y los trastornos con malabsorción gastrointestinal crónica, especialmente la enfermedad de Crohn y la enteropatía sensible al gluten (enfermedad celíaca) (8). A menudo, los síndromes de malabsorción son leves o incluso, asintomáticos, pero aun así parecen capaces de producir deficiencias nutricionales de ácido fólico, vitamina B12 y hierro. Todas han sido relacionadas con úlceras aftosas recidivantes crónicas . (9)
Muchos pacientes relacionan los episodios ulcerosos con la ingesta de ciertos alimentos, especialmente frutos secos y chocolate, mientras que otros presentan asma crónica y/o alergias múltiples. Se ha hallado correlación con el ciclo menstrual, períodos de estrés, ansiedad y con antecedentes familiares de las mismas lesiones.
Sin embargo, hasta la fecha, ninguna etiología definitiva ha sido bien establecida. Dada la gran variedad de trastornos asociados, no se ha elaborado todavía ninguna teoría patogénica unificadora, salvo que las lesiones parecen relacionarse con el sistema inmunitario.
FACTORES INMUNOLÓGICOS
Respuesta celular
En la actualidad las investigaciones dirigidas a determinar la etiología de la EAR se enfocan hacia el componente inmunitario, aunque en el futuro podrían identificarse agentes etiológicos específicos. Sin embargo, sean cuales sean los agentes desencadenantes, son las interacciones del sistema inmunitario, encargado de proteger y reparar al organismo, las que contribuyen principalmente a la magnitud del proceso patológico.
La evidencia inmunológica más importante indica que los individuos afectados por esta enfermedad, podrían sufrir un defecto de la respuesta inmunitaria mediada por células. Existen estudios que indican que en las etapas muy tempranas de la afección pueden observarse linfocitos T CD4, a los que se les adjudica una función de mediadora de la inflamación.
Se ha detectado que las células basales del área afectada expresan de una manera temprana antígenos leucocitarios humanos HLA-DR, lo que sugiere también un papel para estas células. Puesto que se requieren antígenos HLA-DR para presentar un antígeno a las células inmunocompetentes, podría especularse que estas células son autoantígenos que se presentan a los linfocitos T infiltrantes, lo cual conduciría a la destrucción de las células basales. (10, 11)
El principal apoyo para una base inmunitaria se relaciona con alteraciones del número de los subtipos de células T en la sangre periférica en comparación con los controles, los individuos con EAR muestran una relación alterada de células CD4 y CD8, presentando un aumento de linfocitos T CD8+ (12, 13, 14).
Ha sido propuesto que los leucocitos sanguíneos periféricos de los pacientes con EAR, presentan un aumento en la citotoxicidad hacia el epitelio de la mucosa bucal, reforzando de esta manera que la EAR puede representar una reacción tipo citotoxicidad celular dependiente de anticuerpo a la mucosa bucal.(15) Este concepto está apoyado por el conocimiento que las células mononucleares sanguíneas periféricas de los pacientes con EAR, (pero no con enfermedad activa), causan lisis de las células de la mucosa bucal, que expresan antígenos del Complejo Principal de Histocompatibilidad Clase I y II. Más importante, aún es que las células T CD4+ sanguíneas periféricas de los pacientes con EAR también pueden causar lisis epitelial. (12) Es factible entonces, que las reacciones citotóxicas mediadas por las células T CD4+ y CD8,+ ocurran en la EAR.
Existe evidencia sustancial que indica que la EAR es resultado de una respuesta inmune predominantemente mediada por células y, en base a los reportes anteriores, en la actualidad se piensa que la EAR depende de una disfunción inmunológica local, en la cual los linfocitos T desempeñan una función significativa. Sin embargo, la naturaleza del estímulo que inicia el proceso aún es un enigma. El agente causante puede ser un antígeno endógeno (autoinmunitario) o exógeno (hiperinmunitario), o podría ser un factor inespecífico como el traumatismo, en el cual pueden estar implicados mediadores químicos propios de la respuesta inmunitaria.
Respuesta humoral
Entre los cambios reportados en los parámetros inmunes en la EAR, existen hallazgos ambiguos en relación a los niveles séricos de los isotipos de las inmunoglobulinas. En vista de la probabilidad que la EAR tenga una base inmunológica, muchas investigaciones han examinado los niveles séricos de las subclases de la IgG en los pacientes con EAR. Al respecto, algunos autores han reportado aumentos de las inmunoglobulinas A, G, D y E en el suero de diferentes grupos de pacientes con EAR. (16, 17), otros, deficiencias en los niveles séricos en las subclases de la IgG (IgG1, IgG2, IgG3, IgG4). (18), mientras que algunos estudios refieren niveles séricos significativamente más bajos de la IgG2 en la etapa inactiva de la enfermedad, sugiriendo que los niveles séricos de esta subclase de IgG, así como el nivel de la IgA total, pueden sufrir cambios transitorios dependiendo de los diferentes períodos de la enfermedad. (19)
A pesar de las investigaciones existentes no hay una teoría unificadora de la inmunopatogénesis de la EAR. Parece que la ulceración es debida a la acción citotóxica de los linfocitos y monocitos sobre el epitelio bucal, pero el desencadenante de estas respuestas permanece sin aclarar, lo que plantea el estudio de otros componentes del sistema inmunológico.
Moléculas de adhesión celular
Dentro del sistema de defensa, las moléculas de adhesión celular (MACs) están localizadas en las superficies de todas las células, donde ellas se unen a moléculas de la matriz extracelular, o a los receptores presentes sobre otras células. La adhesión de la célula es crítica en los procesos dinámicos, necesarios para la morfogénesis de los tejidos en el desarrollo y, el mantenimiento de tejidos complejos diferenciados en los organismos adultos.
Las MACs tienen la capacidad de conectar el exterior de la célula con el interior. Ellas forman enlaces estructurales entre el citoesqueleto de la célula y la matriz extracelular o entre células, y también funcionan como receptores señalizantes, transduciendo señales iniciadas por interacciones celulares, las cuales regulan procesos muy diversos, incluyendo la división de las células, la migración y la diferenciación.
Las moléculas de adhesión celular son esenciales para el mantenimiento de la estructura estable del epitelio escamoso estratificado. En el epitelio normal, los queratinocitos están unidos a los otros y a la membrana basal subyacente. La adhesión celular, sin embargo, debe ser dinámica para facilitar la movilidad y el recambio de las células.
Actualmente nuevas MACs están siendo todavía identificadas, y las familias que agrupan estas moléculas se están volviendo muy complejas. Se describen, cuatro grupos principales: las integrinas, las caderinas, las selectinas y la superfamilia de las inmunoglobulinas (Ig) (Tabla I). Un grupo separado incluye moléculas tales como la CD44, la cual no se ubica dentro de ninguna de las otras categorías específicas. Las selectinas y las moléculas de la superfamilia de las Ig están expresadas principalmente por células involucradas en la inflamación y en reacciones basadas en la inmunidad (p. ej. los leucocitos y las células endoteliales) (20,21)
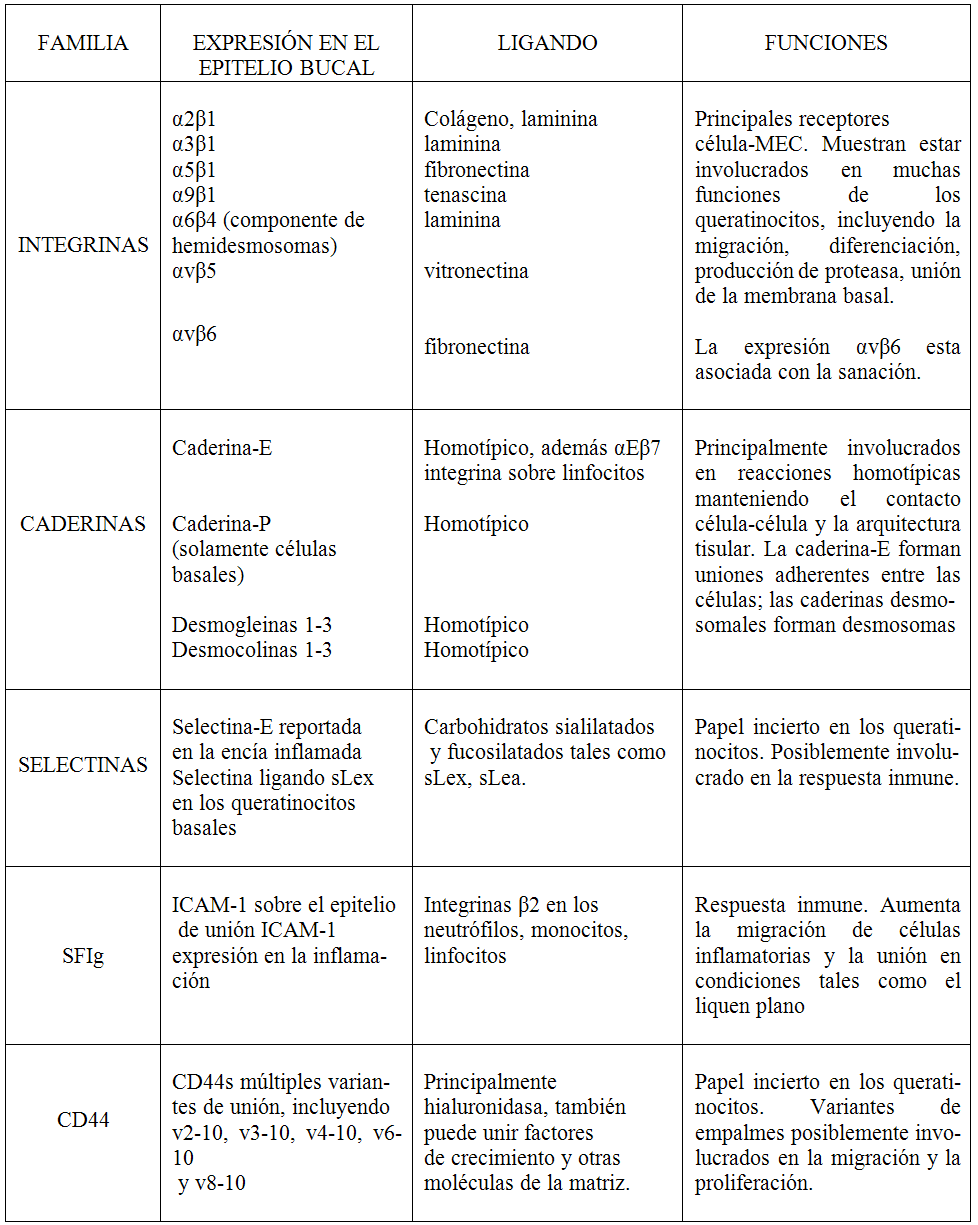
La tabla muestra las clases de moléculas de adhesión expresadas por los queratinocitos en el epitelio bucal normal junto con sus ligandos y funciones
Integrinas
Las integrinas son una familia heterodimérica, de glucoproteínas transmembrana catión-dependientes, halladas virtualmente en todas las células y son la familia más grande de receptores de adhesión-matriz extracelular. Como mediadoras de la adhesión celular, están involucradas en muchos procesos dinámicos que regulan las vías de señalización celular, tales como la proliferación, migración, supervivencia de las células y diferenciación. (21)
Cada integrina consiste de una subunidad α y una β, la cual se asocia en una manera no covalente, para formar heterodímeros funcionales. Dieciséis subunidades α y ocho subunidades β han sido identificadas, y estos se combinan para formar más de 20 receptores, cada cual exhibe un perfil diferente de enlace-ligando. La mayoría de las células expresan por lo menos una, y usualmente varias, la integrina heterodimérica, aunque algunas integrinas son específicas del tejido, como por ejemplo las integrinas β2 están expresadas únicamente sobre los leucocitos.
La mayoría de las células de los mamíferos expresan constitutivamente múltiples integrinas, y muchas de estas pueden ser receptores para el mismo ligando. Las distintas integrinas no están restringidas a un tipo de célula, sugiriendo que la multiplicidad del reconocimiento del ligando no es un reflejo de simples diferencias al tipo específico de célula. El aparente alto grado de redundancia de las integrinas, sugiere que diferentes moléculas de este tipo, median diferentes funciones o diferentes aspectos de la misma función por medio de la transducción de diferentes señales. (22, 23, 24)
Caderinas
Las caderinas son glucoproteínas transmembrana, de cadena-simple, que funcionan de una manera calcio-dependiente. Juegan un importante papel en la clasificación de las células y el reconocimiento durante el desarrollo y están consideradas como importantes reguladoras de la morfogénesis en varios órganos. La sobre-regulación o sub-regulación de la expresión de las caderinas se correlaciona con una variedad de eventos morfogenéticos que involucran agregación o desagregación de la célula. Sin embargo, en el post-desarrollo, las caderinas continúan siendo expresadas en altos niveles en virtualmente todos los tejidos sólidos. A medida que las caderinas están funcionando, la activación de otras MACs tiene poco efecto en la adhesión célula-célula. Por consiguiente parece que las caderinas juegan el principal papel en mantener el contacto físico célula-célula. (25)
Selectinas
Las selectinas son una familia de proteínas transmembrana tipo 1, de cadena simple, halladas en las plaquetas, leucocitos, linfocitos y células endoteliales. Cada selectina está compuesta de un orden de dominios discretos de proteínas. Están caracterizados por un dominio unido a la lectina (la cual da a la familia su nombre).
La familia selectina de las moléculas de adhesión, predominantemente media la fijación inicial de los leucocitos a las células endoteliales, las cuales les permiten rodar a lo largo de la pared del vaso. El rodamiento del leucocito y la subsiguiente extravasación en los sitios de inflamación, involucran una serie de complejas interacciones entre las múltiples familias de las moléculas de adhesión, incluyendo las integrinas y la superfamilia de las inmunoglobulinas. Los tres miembros de la familia de la selectina son: las selectinas-L, -E y -P (CD62L, E, y P, respectivamente).
La selectina-L está constitutivamente expresada en esencialmente todos los neutrófilos sanguíneos y los monocitos, en la mayoría de las células T y B producidas en la sangre, sobre una subclase de células natural killer y sobre células hematopoyéticas inmaduras. La selectina-L media la unión del leucocito para activar el endotelio en los sitios de inflamación, y en la unión del linfocito a las vénulas endoteliales altas de los ganglios linfáticos periféricos, durante el regreso del linfocito. Ya que la selectina-L es ampliamente expresada, esta juega un papel en el tráfico de todos los linajes de leucocitos.
La selectina-P es expresada sobre las plaquetas activadas y las células endoteliales estimuladas. Esta selectina esta constitutivamente sintetizada y es almacenada en los gránulos ? de las plaquetas y en los cuerpos Weibel-Palade de las células endoteliales. Es rápidamente redistribuida a la superficie de la célula, seguida a la estimulación de la célula, pero la expresión es de vida corta. La selectina-P, media tempranamente la adhesión de los neutrófilos y los monocitos, para activar a las plaquetas y a las células endoteliales .
La expresión de la selectina-E está limitada al endotelio que responde a estímulos inflamatorios. La selectina-E media la adhesión de los neutrófilos, monocitos y algunas células T de memoria al endotelio vascular. (20, 21)
Superfamilia de la Inmunoglobulina
La superfamilia de la inmunoglobulina (SFIg) abarca una diversa colección de moléculas que comparten la estructura básica de las inmunoglobulinas, e incluye la familia de la molécula de adhesión intercelular (ICAM), la molécula de adhesión celular vascular (VCAM), molécula de adhesión celular neural (NCAM) y la molécula de adhesión celular del endotelio de la plaqueta (PECAM). No todos los miembros de las SFIg funcionan de la misma manera: la adhesión puede ser dependiente del calcio (ICAM-1, VCAM, PE-CAM) o calcio-independiente (N-CAM, CEA). Las uniones pueden ser heterotípicas (La ICAM-1 es reconocida por las integrinas ?2 halladas en las células sanguíneas blancas, la VCAM reconoce la integrina ?4?1 que se encuentra en los linfocitos) o pueden ser homotípicas, la (PECAM [CD31] reconoce otras moléculas PECAM como su ligando).
Los miembros de las SFIg son particularmente importantes en la inflamación y en las reacciones basadas en la inmunidad. Ellas están involucradas en el tráfico de células, incluyendo la extravasación de células blancas y linfocitos residentes a los ganglios linfáticos (ICAM-1, ICAM-2, VCAM, PECAM-1) (20, 21,26)
Molécula de adhesión intercelular-1 (CD54)
La ICAM-1 esta ampliamente distribuida tanto en las células linfoides como en las no-linfoides y está constitutivamente expresada, en las células endoteliales vasculares y en los linfocitos T y B activados. Tienen una distribución total similar a la de la molécula del Complejo Mayor de Histocompatibilidad, el antígeno leucocitario humano (HLA)-DR. La ICAM-1 está sobre-regulada marcadamente por una variedad de estímulos inflamatorios, tales como el factor de necrosis tumoral y la interleucina-, y parece que esta sobre-regulación es importante en la adhesión y migración de los neutrófilos circulantes y monocitos, los cuales unen la ICAM-1 vía sus integrinas β2. Muchos tipos de células, incluyendo las células epiteliales, pueden ser inducidas para expresar altos niveles de ICAM-1 después de la exposición al interferón-?, una citocina producida por los linfocitos . Los estudios funcionales han demostrado que la expresión de la ICAM-1 en los queratinocitos aumenta la migración de las células inflamatorias y la fijación vía receptor integrina β2 hallada en las células sanguíneas blancas. (27-32)
Molécula de adhesión celular vascular-1 (CD106)
La VCAM es una molécula de adhesión inducible por citoquinas hallada en las células endoteliales, células dendríticas y macrófagos tisulares Está sobre-regulada por los mismos mediadores inflamatorios como la ICAM-1 y sobre el mismo curso de tiempo. La VCAM expresada en células endoteliales activadas por las citocinas, une a la integrina α4β1 a los linfocitos T. (33)
Molécula de adhesión célula endotelial-plaqueta (CD31)
La PECAM (CD31) está altamente expresada sobre las células endoteliales en las uniones intercelulares, sobre las subclases de las células T, y, en menos extensión, sobre la mayoría de los otros leucocitos . La PECAM se une a sí misma homotípicamente y a la integrina αvβ3 heterotípicamente y es requerida para la migración transendotelial de los leucocitos, a través de las uniones intercelulares de las células endoteliales .
Los queratinocitos bucales no expresan constitutivamente la ICAM-1 excepto en el epitelio de la unión , aunque la alta expresión de la ICAM-1 ha sido reportada en las células epiteliales bucales en cultivo. La ICAM-1 es, sin embargo, inducible mediante citocinas en las células epiteliales bucales y parece facilitar la acumulación intraepitelial de los linfocitos T o neutrófilos. En la piel humana, la expresión de la ICAM-1 se correlaciona con la acumulación de linfocitos T en el epitelio , y los queratinocitos bucales basales y las células de Langerhans expresan la ICAM-1 en el liquen plano. La inducción de la expresión de la ICAM-1 por los queratinocitos ha sido también reportada en la ulceración bucal recurrente. (34)
Actualmente existe mucha atención en el papel del endotelio vascular en el reclutamiento de los infiltrados inflamatorios, como el que presenta la EAR. Histológicamente, las lesiones tempranas de EAR, muestran un denso infiltrado linfocítico perivascular, aún antes de que se desarrolle la úlcera, el cual llega después a ser más difuso y mezclado con el influjo de leucocitos polimorfonucleares a medida que la lesión de desarrolla. Las moléculas de adhesión de células endoteliales pueden jugar un papel fundamental en este proceso, incluyendo las moléculas de adhesión de la superfamilia de las inmunoglobulinas: la molécula de adhesión celular vascular-1 (VCAM-1) y la molécula de adhesión intercelular-1 (ICAM-1).Además, las células endoteliales activadas expresando estas moléculas, pueden convertirse en el blanco para el daño citotóxico, contribuyendo a la ruptura del tejido que ocurre en los sitios de la ulceración.(21)
Ciertamente, la VCAM-1 y la ICAM-1 son esenciales para la unión de las células inflamatorias a las células endoteliales. En reportes previos, las formas circulantes de estas moléculas han sido detectadas en un número de procesos de enfermedad vasculítica. La EAR tiene algunas características de un proceso de enfermedad vasculítica. La EAR comúnmente es una condición aislada pero algunas veces está asociada con enfermedades sistémicas (p. ej. la enfermedad de Crohn), la enfermedad celíaca y es una característica del síndrome de Behçet, una condición en la cual se piensa que la vasculitis juega un papel dominante. Esta asociación ha permitido sugerir que un la base de la patogénesis de la EAR, puede ser un proceso vasculítico. (35,36)
ASPECTOS MICROBIOLÓGICOS (virales y bacterianos)
Streptococcus spp ha sido sugerido como un agente importante en la patogénesis de la EAR, tanto como patógenos directos o como un estímulo antigénico, culminando en la génesis de anticuerpos que pueden reaccionar cruzadamente con los determinantes antigénicos de los queratinocitos. La forma L inicial aislada de los pacientes con EAR, fue tipificada como S. sanguis, pero más tarde los análisis revelaron que este organismo era una especie de S. mitis. (37) Mientras que algunos estudios han expuesto títulos elevados de anticuerpos séricos anti- S. viridans entre los pacientes con EAR, otras investigaciones han obtenido resultados contradictorios.(38) Adicionalmente la respuesta mitogénica (in vitro) del linfocito frente a S. sanguis y S. mitis en los pacientes con EAR, no son significativamente diferentes de aquellos en los sujetos control. (39, 40) Más recientemente, se ha demostrado la reactividad cruzada entre una proteína de shock térmico estreptocócica de 60-65-kDa y los niveles significativamente elevados de anticuerpos séricos contra la proteína de shock térmico de la mucosa bucal observada en la EAR (41). También hay reactividad cruzada entre la proteína de shock térmico de 65 kDa y la proteína de shock térmico mitocondrial humana de 60 kDa. De este modo, el desarrollo de la EAR puede ser una respuesta mediada por las células T a los antígenos de (S. sanguis), que reaccionan cruzadamente con la proteína de shock térmico mitocondrial, e inducir de esta forma, el daño en la mucosa bucal. (42)
Helicobacter pylori
El microorganismo Helicobacter pylori, antiguamente llamado (Campylobacter pylori), es un organismo microaerofílico, espiral, gram-negativo, que ha sido reportdo como el agente causal de úlceras estomacales y gastritis crónica activa. (43). No ha sido bien establecido, si la cavidad bucal es un refugio viable permanente de H. pylori o simplemente sirve como la vía de transmisión para otros sitios. Considerando la similitud de las características histológicas entre las úlceras gástricas y las úlceras aftosas bucales, y en vista del hecho que la EAR a menudo responde al tratamiento con un amplio espectro de antibióticos, tales como la tetraciclina, es razonable asumir que H. pylori puede también estar involucrado en el desarrollo de la EAR. Sin embargo, hay limitada evidencia en lo concerniente a la colonización o el posible papel de H. pylori en la EAR.(43)
Los estudios sobre la prevalencia de este microorganismo en la cavidad bucal varían dependiendo de la técnica de detección empleada. De esta forma se ha reportado , (44) basados en la reacción en cadena de la polimerasa (PCR), una tasa de prevalencia del 97% en la cavidad bucal, independientemente del estado de la infección gástrica, sugiriendo que H. pylori puede ser parte de la flora bucal normal. Otros hallazgos sustentan este reporte. (45)
Helicobacter pylori ha sido detectado en el tejido lesionado de úlceras bucales indefinidas (46) y empleando la técnica de PCR se ha observado el microorganismo hasta en el 72% de las úlceras EAR examinadas, pero en ninguna de las muestras de saliva o placa de los mismos pacientes (47) Esto sugiere que H. pylori puede tener un papel etiológico en la EAR y que su presencia en las úlceras no es probablemente debida a su contaminación de otras fuentes. Sin embargo, este hallazgo no esta apoyado por otros estudios, aunque las diferencias metodológicas pueden explicar tal disparidad de resultados, por lo tanto, el papel de H. pylori en la patogénesis de la EAR todavía no está claro. (48, 49, 50)
Infección viral
Muchos científicos han enfocado sus investigaciones hacia una etiología infecciosa de la EAR. A causa de la frecuencia de la infección en la cavidad bucal y quizás en parte debido a la similitud en la aparición y duración, Virus Herpes Humano (VHH) ha sido un blanco favorito de esos estudios. Algunos grupos han encontrado asociaciones entre la EAR y virus herpes, incluyendo virus Epstein Barr, Citomegalovirus y Varicella zoster (51, 52)
Al respecto, se han realizado algunos estudios empleando la técnica de reacción en cadena de la polimerasa, para examinar la mucosa bucal y los leucocitos sanguíneos periféricos para detectar la presencia de virus herpes simple 1 y 2, virus varicela zoster, virus Epstein Barr, citomegalovirus, virus herpes humano-6 y virus herpes humano-7. Los resultados no demuestran ninguna diferencia en cuanto a la presencia del ADN de virus herpes entre los casos de EAR y los controles normales, por lo que no se sugiere un papel directo de algún VHH en la patogénesis de la EAR, argumentando que la presencia de estos virus sea probablemente debido a un flujo normal. Una asociación de la EAR con Adenovirus también ha sido sugerida, pero estos resultados necesitan confirmación .(53)
La posible asociación de la EAR con los virus herpes 1-6 también había sido revisada con anterioridad (54). El ARN complementario de virus herpes simple (VHS) ha sido detectado en las células mononucleares circulantes de algunos pacientes con EAR . Las partículas parecidas al virus han sido observadas en algunos tejidos en el síndrome de Behçet pero no en la mucosa bucal y no han sido confiablemente demostradas en la EAR. (54) Virus herpes simple no ha sido exitosamente aislado de material de las lesiones, solo cerca de un tercio de los pacientes con EAR son VHS-seropositivos y VHS ha sido raramente detectado en tejido lesionado por la reacción en cadena de la polimerasa (55)
Sin embargo, las pruebas serológicas de los niveles de los anticuerpos IgM e IgG para virus varicela zoster (VVZ) pueden estar elevados en algunos pacientes con EAR (56), sugiriendo una asociación entre la reactividad del VVZ y la EAR. Además, el ADN de VVZ puede ser detectado por PCR en el tejido lesionado; aunque, la contaminación es posible y puede sustentar estas observaciones. Pero hay pocos datos reportados para concluir que antivirales anti-virus herpes tales como el aciclovir son de beneficio terapéutico en el manejo de la EAR (57).
Así mismo, existen datos serológicos y de biología molecular contradictorios sobre la frecuencia de detección de la infección de citomegalovirus y de virus varicela zoster en pacientes con EAR. Los anticuerpos para citomegalovirus (CMV) pueden estar significativamente elevados en algunos pacientes con EAR (58) y el ADN de CMV ha sido detectado en ulceraciones bucales indefinidas en personas no infectadas por VIH.
Algunos reportes han referido la detección de Virus Herpes Humano-6 (VHV-6), en lesiones de EAR, pero estos resultados no fueron estadísticamente más altos que los detectados en la población control.(59) Sin embargo, el 95% de estos pacientes tenían anticuerpos IgM para el VHH-6, lo cual condujo a sostener que la reactivación del HHV-6 puede jugar un papel en el desarrollo de la EAR.
Las evidencias aportadas por los trabajos revisados no reflejan datos epidemiológicos definitivos para sustentar una etiología infecciosa viral para la EAR.
BIBLIOGRAFIA
|